はじめに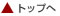
ゼアキサンチンは、これまで同じキサントフィル類に属するルテインと共存しているカロテノイドとして見なされることが多く、研究でもこれらのカロテノイドが lutein/zeaxanthin、 lutein+zeaxanthin、lutein/+zeaxanthin などとして評価される場合が少なくありません。しかしながら、他のカロテノイド同様、ゼアキサンチンを個別に調査する研究も次第に増え、ゼアキサンチンが私たちにもたらしてくれる健康上の利点が見出されつつあります。
ある小さな食品の存在から、ゼアキサンチンは東アジア文化圏の人々との関りが最も古いカロテノイドの一つであると言うことができるかも知れません。その食品はクコ(和名: 枸杞、学名: Lycium chinense)と呼ばれる中国原産のナス科の植物で(図 1)、漢方薬のみならず薬膳から生食までの食材として幅広く利用されてきた長い歴史があります。
| 図1. | 乾燥させたクコの実(枸杞子くこし)。 |  |
クコは他の幾つかの植物(ホオズキ、オレンジペッパー、スナヂグミなど)と共にゼアキサンチンの有用な供給源であることが最近の研究で明らかにされ、クコに含まれるゼアキサンチンのような成分と特定の有益性との関係が再び注目されるようになりました[1-4]。
2008 年 6 月に沖縄で開催された第 15 回国際カロテノイド学会では、眼科領域で世界的に著目な研究者の一人であるユタ大学の Bernstein 教授により「アジアの伝統的医療では枸杞子のようなカロテノイド豊富なハーブが眼の健康に価値のあることが長年にわたり認知されているのに対し、米国で加齢黄斑変性(AMD; 後述「報告されているゼアキサンチンの健康上の利点」参照)の危険に曝されている人にルテインとゼアキサンチンのサプリメントが強く推奨されるようになったのは僅か 10 年程前からである」とする興味深い見解が述べられました[5]。
これまでに英国[6]や米国[7]で発表された一般に消費される食品に含まれるカロテノイドの分析データを見る限り、ルテインや β-カロテンの場合とは異なり、ゼアキサンチンを豊富に含む食品は(パプリカとしても知られる)オレンジペッパーやトウモロコシなどと種類が限られる上、緑色野菜にはゼアキサンチンが検出されないか、あるいはあまり含まれていないことがわかります(図 2)。
| 図2. | 主要な野菜・果物の可食部100 gあたりゼアキサンチン含有量(単位: μg) |  |
|
|
|||
Sommerburg らの研究結果にもあるように、ルテイン・ゼアキサンチン摂取のために以前から推奨されている濃緑色の葉菜のほとんどは 15〜47%のルテインを含む一方、ゼアキサンチン 含量は低いため(0〜3%)、ルテイン・ゼアキサンチンの摂取量増加を図るためにはさまざまな色彩を有する野菜・果物の消費が必要とされています[8]。ゼアキサンチン豊富な他の植物性供給源としては、日本をはじめとする東アジアの固有種である柿が挙げられ、生食用柿の可食部 100g あたりゼアキサンチン含有量が 488 μg という報告もあります[7,9]。
一方、動物性の食品の中では、ルテインの場合と同様、鶏卵が少なくともヒトの網膜組織において生物学的利用能の高いゼアキサンチン供給源であることが研究によって明らかにされ ています[10]。既出 Sommerburg らの研究から得られたデータでは、卵黄中のゼアキサンチン濃度は 35 mol%とされ、トウモロコシ(25 mol%)を超え、オレンジペッパー中の濃度(37 mol%)と比べても遜色ない値が報告されています。また、卵黄中の総カロテノイドに占めるルテイン+ゼアキサンチンの濃度は 89 mol%と調査した食品の中で最高値を示しています[8]。
体内分布
ヒトの血液と主要組織中のカロテノイド分布:
ゼアキサンチンは私たちの体内で合成されないため、日常的にカロテノイドが豊富に含まれる食品から適切な摂取を心掛けることが大切です。食事に由来するゼアキサンチンをはじめとする複数のカロテノイドが私たちの血液や母乳中に存在し、現在までのところ25種類の食事性のカロテノイドと8種類のカロテノイド代謝物(それらのシス異性体は除く)が検出されています[11-13]。
ゼアキサンチンもまた、野菜・果物を豊富に摂取している健常人の血清中に存在が認められる主要なカロテノイドの一つであることがKhachikらの研究によって明らかにされています(表1)。
- 表1.
- 野菜・果物を豊富に摂取している健常人の血清中の主要なカロテノイドの分布
| No. | 食事性カロテノイド | 血清中の分布(%) |
|---|---|---|
| 1 | ルテイン* | 20 |
| 2 | リコピン* | 20 |
| 3 | β-カロテン* | 10 |
| 4 | α-カロテン* | 6 |
| 5 | ゼアキサンチン* | 3 |
| 6 | ζ-カロテン | 10 |
| 7 | フィトフルエン | 8 |
| 8 | β-クリプトキサンチン | 8 |
| 9 | α-クリプトキサンチン | 4 |
| 10 | フィトエン | 4 |
| 11 | アンハイドロルテイン | 3 |
| 12 | γ-カロテン | 2 |
| 13 | ニューロスポレン | 2 |
- * 発表時点(1997年)の商業的入手可能性を優先
- [文献11より引用改変]
現在までに8種類のカロテノイド代謝物(シス異性体を除く)がヒトの血液・組織中に認められており、それらの代謝物はおそらく各々の親化合物が酸化的に代謝されて生成したものであろうと考えられています。その親化合物にはルテイン、リコピンの他にゼアキサンチンが含まれます。
リコピン、ルテイン、ゼアキサンチンの酸化代謝物の存在から、これらの食事性カロテノイドが抗酸化剤としての役割を果たすことが証明されています。さらにそれらのカロテノイドには、抗酸化機構に加えて、抗炎症特性、抗腫瘍促進活性も認められることが研究から明らかにされています[15]。
Khachik ら[12,16]、Hata ら[17]の研究グループは、これまでにヒトの肝臓[16]、肺[16]、乳房[16]、子宮頚部[16]、前立腺[12]、大腸[12]、皮膚[17]といった組織から 1g あたり ng から μg のレベルでカロテノイドとそれらの代謝物を検出し、ヒトの血清に存在する食事性カロテノイドはこれらの器官や組織にも蓄積していることを明らかにしました(表 2)。
| 表2. | ヒトの組織と皮膚における食事性カロテノイドとそれらの代謝物 |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ヒトの眼組織中のカロテノイド分布:
1945年、Wald教授によってヒト網膜黄斑部(図3)に存在する黄斑色素は酸素分子を含んだカロテノイドあるいはキサントフィルであることが判明し、哺乳類の網膜中にこの種のカロテノイドの存在が初めて確認されました[18]。
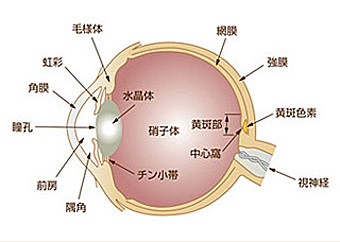
- 図3.
- 眼組織の断面模式図
その40年後の1985年にBoneらが行った研究から、ヒトの黄斑色素はクロマトグラフィーで分離可能な2種類の成分、(3R,3'R,6'R)-β,ε-carotene-3,3'-diolと(3R,3'R)-β,β-carotene-3,3'-diolから構成されていることが明らかになり、これらはそれぞれルテイン、ゼアキサンチンとして同定されました[19]。
1997年、Khachikらは、ヒトとアカゲザル(Macaca mulatta)の網膜からカロテノイドとそれらの代謝物を合わせた14種類を完全に特徴付けし、ルテインとゼアキサンチンの酸化代謝物の存在を証明しました[20]。
ヒト網膜におけるカロテノイドの代謝変換の過程で鍵となるルテインと 3'-epilutein(ルテイン・ゼアキサンチンの代謝物)の直接的な酸化生成物である3-hydroxy-β,ε-caroten-3'-oneの存在から、ルテインやゼアキサンチンが黄斑部を短波長の可視光線(青色光)から保護するために抗酸化剤として機能を果している可能性のあることが結果から示唆されました。
2000 年代に入ると、眼の生理学についてより優れた洞察を得るために、ユタ大学 Moran Eye Center の Bernstein らの研究グループがメリーランド大学の Khachik らの研究グループと共同でヒトのすべての眼組織における食事性カロテノイドとそれらの酸化代謝物の全種類について同定、定量化を行う試験を計画しました[21]。
得られた定量的なデータから、とりわけゼアキサンチンは網膜の中心領域である黄斑部にルテインを上回るレベルで局在していることが明らかになりました。また、カロテノイドとしてはルテインとゼアキサンチンの2種類しか存在が認められないとされる水晶体においても[22]、ルテインとほぼ同じ割合でゼアキサンチンが見出されています(表3)。
| 表3. | ヒトドナーの各眼組織におけるルテインとゼアキサンチンの含有量 |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
このBernsteinらの研究により、眼組織に存在するルテイン、ゼアキサンチン、及び他のカロテノイドが、光によって誘発される酸化的損傷と老化から眼を保護するために果している重要な役割がさらに裏付けられました。
報告されているゼアキサンチンの健康上の利点
これまでに科学雑誌や学術会議で発表された研究から、ゼアキサンチンは生体内における特徴的な分布を少なくとも部分的に反映しながら、とりわけ以下のような分野でそれぞれ他の異なる種類の栄養成分と共に重要な役割を担っている可能性のあることが報告されています。
冒頭でも述べましたように、これまでゼアキサンチンはルテインと一緒に評価される場合が多く、他の異なるカロテノイドと共に独立して調査された報告の数にはまだ限りがありますが、その中でもゼアキサンチンが特異的な局在を示す幾つかの眼組織を中心に以下の分野で興味深い所見が得られています。
網膜中心部における黄斑色素の濃度
黄斑色素は主にルテインとゼアキサンチンの2種類のキサントフィルカロテノイドから構成され、その濃度は霊長類の網膜組織において最も集光する黄斑部の中心軸(中心窩あるいは中心小窩、図4)に向かって高くなることが、1984年に発表されたSnodderlyらの研究結果から明らかになりました [23]。
| 図4. | アカゲザル(Macaca mulatta)の網膜断面模式図 | 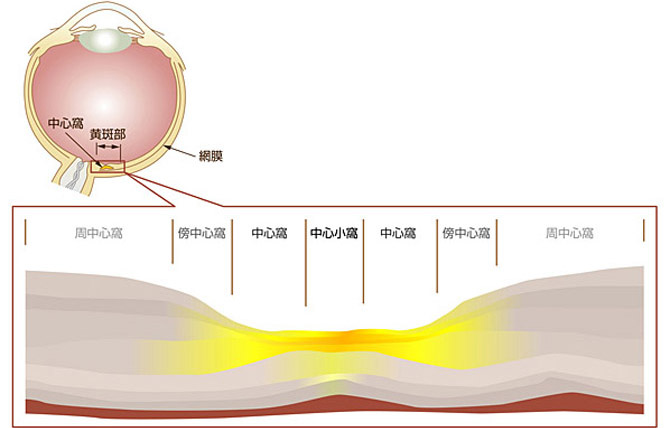 |
|
|
|||
その後、Boneらがゼアキサンチン濃度と中心窩からの距離との間に相関関係が存在することを明らかにし、ゼアキサンチンは中心窩から約2.5 mmまでの距離における主要な色素であるのに対し、ルテインはその範囲を超えた地点で濃度が高くなることを見出しました[24]。
さらに、これら二つの異なる研究グループにより、中心窩からの距離によって変化するルテインとゼアキサンチンの比は、対応する杆体(暗所視で光覚を司る視細胞)と錐体(明所視で色覚を司る視細胞)の異なる2種類の視細胞の比との間に線形の相関が認められ、共に中心窩に向かって比率が上昇するゼアキサンチンと錐体細胞との関連性が示唆されるようになりました[24,25]。
網膜中の黄斑色素濃度とAMD(視覚を司る網膜黄斑部の中心領域が障害されて起る非可逆性の疾患、図5)のリスクとの間の関連性を究明するために、AMDのドナーとAMDでないドナーから採取した網膜組織について調査を行ったケースコントロール研究から得られた結果は、AMDリスクと網膜中のルテイン・ゼアキサンチン濃度との逆の関連を提案する理論モデルと一致しましたが、網膜に含まれるこれらのカロテノイドの減少はAMDの破壊作用によるものであるとするモデルとは矛盾が認められました[26]。
網膜の中心窩を軸として同心円状に切り分けた、内部、中間、外部の3種類すべての領域におけるルテインとゼアキサンチンを合わせた平均濃度は対照ドナーよりAMDドナーで低く、またAMDドナーとそうでないドナーとの間の濃度差の程度は内部領域から中間領域、中間領域から外部領域に行くに従って小さくなることが研究から明らかとなり、罹患原因の一つにAMDドナーの網膜組織の内部-中間領域で認められる黄斑色素濃度の低値が可能性として示唆されました[26]。
加齢黄斑変性(AMD)、加齢黄斑症(ARM)
社会の高齢化に伴う健康問題は私たちの視機能にも及び、これまで西洋社会における中途失明の主因とされてきた AMD(図 5)が日本においても今後高齢者を中心に拡大するおそれがあります[27]。
| 図5. | 正常視野(左)と AMDに罹患した視野(右)の想像図 |
 |
1994年にSeddonらにより発表された多施設症例対照研究の結果から、食事由来のルテイン・ゼアキサンチン摂取量が最も高いグループ(1日約 5.8 mg)で最も低いグループ(同約0.6 mg)と比べて57%のAMDリスク低下が統計上有意に認められて以来[28]、その関係をさらに調査する他の研究が今日までに多数発表されてきました。
2000年代に入り、AMD予防の分野でヒトを対象にルテインとゼアキサンチンを個別に調査した報告も散見されるようになりました。イングランド(Galeら)[29]、南フランス(POLA研究グループ)[30]の人口集団を対象に行われた二つの異なる研究ではルテインとゼアキサンチンが個別に評価され、共にカロテノイドのなかでもとりわけゼアキサンチンの血漿濃度とAMDあるいはARM(図6)のリスク低下との関連が強く認められたのは興味深いところです。前者の研究ではさらに、それら二種類のキサントフィルカロテノイドの担う役割が同一ではない可能性も示唆されています。
| 図6. | 加齢黄斑症及び加齢黄斑変性(AMD)の分類概略 | 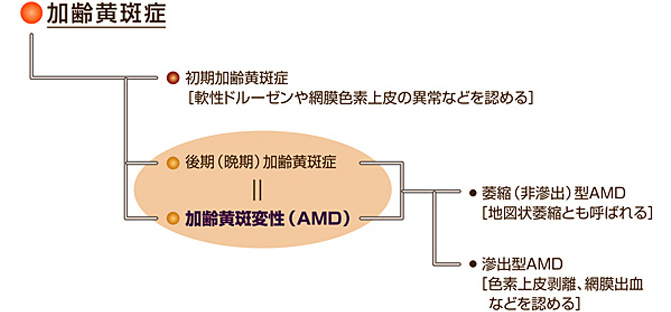 |
|
|
|||
目下、進行性AMDの高リスクにある高齢者において第二世代の抗酸化処方(1日EPA 650 mgとDHA 350 mgの有り無しで、ルテイン10 mg、ゼアキサンチン2 mg)を前向きに調査するために、米国国立眼科研究所(NEI)が50歳から85歳までの約4,000人の参加者を対象に大規模な多施設無作為化プラセボ対照比較試験(AREDS2: Age-Related Eye Disease Study 2)を実施しています[31]。
最初のAge-Related Eye Disease Study(AREDS)は学界、産業界の両方に影響力を及ぼした大規模なヒト介入試験であり、またコクランシステマティックレビューによる調査でも AMDの進行阻止における抗酸化ビタミン・ミネラル(β-カロテン、ビタミンE、ビタミンC、亜鉛)の補給効果に関する証拠はAREDSによってもたらされたことから[32]、進行中のAREDS2で発表される報告に今から多大な関心が寄せられています。
加齢性白内障
1995年、タフツ大学のYeumらの研究グループが米国人とインド人から提供を受けた水晶体を対象にカロテノイド、レチノイド、トコフェロールの含量測定を行った試験から、ヒトの水晶体から検出されるカロテノイドはルテインとゼアキサンチンの二種類であることが初めて明らかになりました[22]。結果から、パルミチン酸レチノール、α-トコフェロール、γ-トコフェロールのような抗酸化ビタミンとこれらのキサントフィルカロテノイドの存在により、水晶体に含まれる栄養素の濃度決定因子の一つとして食事因子の重要性が考えられるようになりました。
今日まで、食事・サプリメント由来のカロテノイドの摂取量、それらの血中濃度あるいは黄斑色素濃度と、白内障の有病率、重症度あるいはサブタイプ(核白内障、皮質白内障、後嚢下白内障)との関係が多数の研究で調査され、ゼアキサンチンを含むカロテノイドの豊富な摂取に加齢性白内障から防護する可能性のあることが示唆されています[34-44]。
AMDの項でご紹介差し上げたPOLA研究では血漿カロテノイド濃度と白内障リスクとの関係も調査されており、キサントフィルカロテノイドのなかでもとりわけゼアキサンチンの保護的役割が強く示唆されました[30]。
またAREDS2でも[31]、ルテインとゼアキサンチン、あるいはこれらのキサントフィルカロテノイドとEPA・DHAの組み合わせによる補給の白内障に及ぼす影響が調査されており、進行性AMDや中等度の視覚喪失に及ぼす影響と共に多大な関心が寄せられています。
キサントフィル結合タンパク質(XBP)
ゼアキサンチンが眼組織における加齢性の健康問題に果たす役割に加え、研究の焦点は網膜に局在するキサントフィル類のカロテノイドの吸収、代謝、安定化にも向けられてきました。
2000年代に入り、それらには特定のキサントフィル結合タンパク質(XBP)が介在しているとする概念が構築され、ヒト網膜に特異的なXBPの存在とゼアキサンチンをはじめとするキサントフィル類との相互作用が注目されるようになりました。
ユタ大学のBernsteinらの研究グループは、その後の研究でキサントフィルと特異的に結合するタンパク質(XBP)をヒト網膜から精製し、最も高度に精製されたXBPにおける主要なタンパク質をグルタチオンS-トランスフェラーゼ P1(GSTP1)のイソ型として同定しました[45]。
GSTP1は高い特異性と親和性でゼアキサンチンと結合する一方、ルテインとは結合しないことが、同じBernsteinらの研究グループによって明らかにされました。さらに、GSTP1に対する抗体を用いた免疫細胞化学に関する実験で、そのタンパク質の組織分布が網膜におけるゼアキサンチンの既知の分布と一致することが実証されました[45,46]。
ルテインと共に網膜中心部や水晶体に特異的な分布を示すゼアキサンチンは、提案されている抗酸化剤及び光学フィルターとしての機能から、とりわけ加齢に伴う眼の健康問題に関連した研究で注目を浴びる機会が最近増えていますが、私たちの血液や母乳中に存在が認められる主要な食事性カロテノイドの一つとして他にも健康利益をもたらし得ることが明らかにされています。
- 最近の研究から
- 文献データベース
- ゼアキサンチンあるいはゼアキサンチンと他の栄養成分との組み合わせが果たす役割は、上述の分野以外でも解明が進んでいます。関連情報は、疫学調査、臨床試験、あるいは in vitro、in vivo 実験の結果から得られた興味深い所見とともに、最近の研究から、文献データベースのページで随時取り上げてまいります。折に触れてご確認いただけましたら幸いです。
参考文献・参考URL
- 1.
-
- Weller P, Breithaupt DE. Identification and quantification of zeaxanthin esters in plants using liquid chromatography-mass spectrometry. J Agric Food Chem. 2003 Nov 19;51(24):7044-9.
- 2.
-
- Cheng CY, Chung WY, Szeto YT, Benzie IF. Fasting plasma zeaxanthin response to Fructus barbarum L. (wolfberry; Kei Tze) in a food-based human supplementaion trial. Br J Nutr. 2005 Jan;93(1):123-30.
- 3.
-
- Benzie IF, Chung WY, Wang J, Richelle M, Bucheli P. Enhanced bioavailability of zeaxanthin in a milk-based formulation of wolfberry (Gou Qi Zi; Fructus barbarum L.). Br J Nutr. 2006 Jul;96(1):154-60.
- 4.
-
- Kim HP, Kim SY, Lee EJ, Kim YC, Kim YC. Zeaxanthin dipalmitate from Lycium chinense has hepaoprotective activity. Res Commun Mol Pathol Pharmacol. 1997 Sep;97(3):301-14.
- 5.
-
- Bernstein PS, Bhosale P, Li BX, Serban B, Frederick JM, Sharifzadeh M, Gellermann W, Tsuchida K. The protective role of dietary carotenoids in the human eye: insights from Japanese quail and Asian silkworms. Abstract presented at the 15th International Symposium on Carotenoids. Okinawa, Japan, 22 – 27 June 2008.
- 6.
-
- Hart DJ and Scott KJ. Development and evaluation of an HPLC method for the analysis of carotenoids in foods, and the measurement of the carotenoid content of vegetables and fruits commonly consumed in the UK. Food Chem. 1995;54:101-111.
- 7.
-
- Holden JM, Eldridge AL, Beecher GR, Buzzard IM, Bhagwat S, Davis CS, Douglass LW, Gebhardt S, Haytowitz D, Schakel S. Carotenoid content of U.S. foods: an update of the database. J Food Compost Anal. 1999;12:169-96.
- 8.
-
- Sommerburg O, Keunen JF, Bird AC, van Kuijk FJ. Fruits and vegetabes that are sources for lutein and zeaxanthin: the macular pigment in human eyes. Br J Ophthalmol. 1998 Aug;82(8):907-10.
- 9.
-
- Philip T and Chen TS. Quantitative analyses of major carotenoid fatty acid esters in fruits by liquid chromatography: persimmon and papaya. J Food Sci. 1988;53:1720-45.
- 10.
-
- Wenzel AJ, Gerweck C, Barbato D, Nicolosi RJ, Handelman GJ, Curran-Celentano J. A 12-wk egg intervention increases serum zeaxanthin and macular pigment optical density in women. J Nutr. 2006 Oct;136(10):2568-73.
- 11.
-
- Khachik F, Nir Z, Ausich RL, Steck A, Pfander H. Distribution of carotenoids in fruits and vegetables as a criterion for the selection of appropriate chemopreventive agents. In: Yoshikawa T, Ohigashi H, eds. Food Factors for Cancer Prevention. Tokyo: Springer-Verlag; 1997. 204-8.
- 12.
-
- Khachik F, Carvalho L, Bernstein PS, Muir GJ, Zhao DY, Katz NB. Chemistry, distribution, and metabolism of tomato carotenoids and their impact on human health. Exp Biol Med (Maywood). 2002 Nov;227(10):845-51.
- 13.
-
- Khachik F, Spangler CJ, Smith JC Jr, Canfield LM, Steck A, Pfander H. Identification, quantification, and relative concentrations of carotenoids and their metabolites in human milk and serum. Anal Chem. 1997 May 15;69(10):1873-81.
- 14.
-
- Jackson JG, Zimmer JP. Lutein and zeaxanthin in human milk independently and significantly differ among women from Japan, Mexico, and the United Kingdom. Nutr Res. 2007 Aug; 27(8):449-53.
- 15.
-
- Khachik F. New World Trend of Carotenoids Studies. Development of a multicarotenoid dietary supplement for chemoprevention of cancer and macular degeneration. Manuscript prepared on 8 March 2001.
- 16.
-
- Khachik F, Askin FB, Lai K. Distribution, bioavailability, and metabolism of carotenoids in humans. In: Bidlack WR, Omaye ST, Meskin MS, Jahner D. Eds. Phytochemicals, a New Paradigm. Lancaster, PA: Technomic Publishing; 1998. 77-96.
- 17.
-
- Hata TR, Scholz TA, Ermakov IV, McClane RW, Khachik F, Gellermann W, Pershing LK. Non-invasive Raman spectroscopic detection of carotenoids in human skin. J Invest Dermatol. 2000;115:441-8.
- 18.
-
- Wald G. Human vision and the spectrum. Science. 1945 Jun; 101(2635):653-658.
- 19.
-
- Bone RA, Landrum JT, Tarsis SL. Preliminary identification of the human macular pigment. Vision Res. 1985;25(11):1531-5.
- 20.
-
- Khachik F, Bernstein PS, Garland DL. Identification of lutein and zeaxanthin oxidation products in human and monkey retinas. Invest Ophthalmol Vis Sci. 1997 Aug;38(9):1802-11.
- 21.
-
- Bernstein PS, Khachik F, Carvalho LS, Muir GJ, Zhao DY, Katz NB. Identification and quantitation of carotenoids and their metabolites in the tissues of the human eye. Exp Eye Res. 2001 Mar;72(3):215-23.
- 22.
-
- Yeum KJ, Taylor A, Tang G, Russell RM. Measurement of carotenoids, retinoids, and tocopherols in human lenses. Invest Ophthalmol Vis Sci. 1995 Dec;36(13):2756-61.
- 23.
-
- Snodderly DM, Auran JD, Delori FC. The macular pigment. II. Spatial distribution in primate retinas. Invest Ophthalmol Vis Sci. 1984 Jun;25(6):674-85.
- 24.
-
- Bone RA, Landrum JT, Fernandez L, Tarsis SL. Analysis of the macular pigment by HPLC: retinal distribution and age study. Invest Ophthalmol Vis Sci. 1988 Jun;29(6):843-9.
- 25.
-
- Snodderly DM, Handelman GJ, Adler AJ. Distribution of individual macular pigment carotenoids in central retina of macaque and squirrel monkeys. Invest Ophthalmol Vis Sci. 1991 Feb;32(2):268-79.
- 26.
-
- Bone RA, Landrum JT, Mayne ST, Gomez CM, Tibor SE, Twaroska EE. Macular pigment in donor eyes with and without AMD: a case-control study. Invest Ophthalmol Vis Sci. 2001 Jan;42(1):235-40.
- 27.
-
- Yasuda M. Epidemiology of AMD. In: Shiraga F, Maeda N, eds. Ophthalmic Instruction Course No.5. Tokyo: Medical View; 2005 Nov:16-9.
- 28.
-
- Seddon JM, Ajani UA, Sperduto RD, Hiller R, Blair N, Burton TC, Farber MD, Gragoudas ES, Haller J, Miller DT, Yannuzzi LA, Willett W. Dietary carotenoids, vitamin A, C, and E, and advanced age-related macular degeneration. JAMA. 1994;272:1413-20.
- 29.
-
- Gale CR, Hall NF, Phillips DIW, Martyn CN. Lutein and zeaxanthin status and risk of age-related macular degeneration. Invest Ophthalmol Vis Sci. 2003 Jun;44(6):2461-5.
- 30.
-
- Delcourt C, Carrière I, Delage M, Barberger-Gateau P, Schalch W; POLA Study Group. Plasma lutein and zeaxanthin and other carotenoids as modifiable risk factors for age-related maculopathy and cataract: the POLA Study. Invest Ophthalmol Vis Sci. 2006 Jun;47(6):2329-35.
- 31.
-
- Age-Related Eye Disease Study 2.http://www.areds2.org/ (accessed Jan 2008)
- 32.
-
- Evans JR. Antioxidant vitamin and mineral supplements for slowing the progression of age-related macular degeneration. Cochrane Database Syst Rev. 2006 Apr 19;(2):CD000254.
- 33.
-
- Bird AC, Bressler NM, Bressler SB, Chisholm IH, Coscas G, Davis MD, de Jong PT, Klaver CC, Klein BE, Klein R, et al. An international classification and grading system for age-related maculopathy and age-related macular degeneration. The International ARM Epidemiological Study Group. Surv Ophthalmol. 1995 Mar-Apr;39(5):367-74.
- 34.
-
- Hammond BR Jr, Wooten BR, Snodderly DM. Density of the human crystalline lens is related to the macular pigment carotenoids, lutein and zeaxanthin. Optom Vis Sci. 1997 Jul;74(7):499-504.
- 35.
-
- Chasan-Taber L, Willett WC, Seddon JM, Stampfer MJ, Rosner B, Colditz GA, Speizer FE, Hankinson SE. A prospective study of carotenoid and vitamin A intakes and risk of cataract extraction in US women. Am J Clin Nutr. 1999 Oct;70(4):509-16.
- 36.
-
- Brown L, Rimm EB, Seddon JM, Giovannucci EL, Chasan-Taber L, Spiegelman D, Willett WC, Hankinson SE. A prospective study of carotenoid intake and risk of cataract extraction in US men. Am J Clin Nutr. 1999 Oct;70(4):517-24.
- 37.
-
- Yeum KJ, Shang FM, Schalch WM, Russell RM, Taylor A. Fat-soluble nutrient concentrations in different layers of human cataractous lens. Curr Eye Res. 1999 Dec;19(6):502-5.
- 38.
-
- San Giovanni JP, Chew EY, Agron E, Reed GF, Sperduto RD, Ferris FL, the AREDS Research Group. Dietary carotenoids and cataract in the age-related eye disease study. Abstract presented at the 14th International Symposium on Carotenoids, Edinburgh, Scotland, 17–22 July 2005.
- 39.
-
- Delcourt C, Carrière I, Delage M, Barberger-Gateau P, Schalch W; POLA Study Group. Plasma lutein and zeaxanthin and other carotenoids as modifiable risk factors for age-related maculopathy and cataract: the POLA Study. Invest Ophthalmol Vis Sci. 2006 Jun;47(6):2329-35.
- 40.
-
- Vu HT, Robman L, Hodge A, McCarty CA, Taylor HR. Lutein and zeaxanthin and the risk of cataract: the Melbourne visual impairment project. Invest Ophthalmol Vis Sci. 2006 Sep;47(9):3783-6.
- 41.
-
- Rodríguez-Rodríguez E, Ortega RM, López-Sobaler AM, Aparicio A, Bermejo LM, Marín-Arias LI. The relationship between antioxidant nutrient intake and cataracts in older people. Int J Vitam Nutr Res. 2006 Nov;76(6):359-66.
- 42.
-
- Christen WG, Liu S, Glynn RJ, Gaziano JM, Buring JE. Dietary carotenoids, vitamins C and E, and risk of cataract in women: a prospective study. Arch Ophthalmol. 2008 Jan;126(1):102-9.
- 43.
-
- Moeller SM, Voland R, Tinker L, Blodi BA, Klein ML, Gehrs KM, Johnson EJ, Snodderly DM, Wallace RB, Chappell RJ, Parekh N, Ritenbaugh C, Mares JA; CAREDS Study Group; Women's Helath Initiative. Associations between age-related nuclear cataract and lutein and zeaxanthin in the diet and serum in the Carotenoids in the Age-Related Eye Disease Study, an Ancillary Study of the Women's Health Initiative. Arch Ophthalmol. 2008 Mar;126(3):354-64.
- 44.
-
- Dherani MK, Murthy GV, Gupta SK, Young I, Maraini G, Camparini M, Price GM, John N, Chakravarthy U, Fletcher A. Blood levels of vitamin C, carotenoids and retinol are inversely associated with cataract in a north Indian population. Invest Ophthalmol Vis Sci. 2008 Apr 17.
- 45.
-
- Bhosale P, Larson AJ, Frederick JM, Southwick K, Thulin CD, Bernstein PS. Identification and characterization of a Pi isoform of glutathione S-transferase (GSTP1) as a zeaxanthin-binding protein in the macula of the human eye. J Biol Chem. 2004 Nov 19;279(47):49447-54.
- 46.
-
- Bernstein PS, Bhosale P, Frederick JM, Southwick K, Thulin CD. A proteomic approach to the biochemistry of xanthophyll carotenoids in human and avian ocular and nonocular tissues. Abstract presented at the 14th International Symposium on Carotenoids, Edinburgh, Scotland, 17–22 July 2005.

